domingo, 9 de diciembre de 2012
Portada
Centro de Bachillerato Tecnologico Industrial y de Servicios No. 134
"Nicolas Catalan"
Materia: Procesar Tecnicas Bacteriologicas Basicas (PTBB)
Profesor: Martin Castulo Acosta
Equipo: Aguayo Basilo Eduardo Isaid
Bello Rendon Edgar Alain
Damian Flores Zhaid Alejandro
De la Cruz Piedra Alberto
Montiel Manuel
Grado: 3º semestre Grupo: D
Especialidad: Laboratorista Clinico
Practica 5
Practica Nº 5
CONOCIMIENTO
Y USO DEL MICROSCOPIO
Objetivo
general:
Que el alumno aprenda a manejar
correctamente el microscopio, y conocer su utilidad en el laboratorio.
Objetivos
particulares:
1. Enfocar correctamente cualquier
muestra que se coloque en el microscopio
2. Aprender a mantener en buen estado un
microscopio
3. Establecer qué clase de muestras se
pueden colocar en el microscopio
INTRODUCCION
El microscopio simple utilizado por
Anton Van Leeuwenhoeek en el siglo XVII tenía una sola lente y era similar a
una lupa pero Van Leeuwenhoeek era el mejor tallador de lentes del mudo de su
tiempo. Tallaba sus lentes con tanta precisión que una lente solo podía
aumentar un microbio 300x y gracias a sus microscopios simples fue la primera
persona que pudo ver las bacterias.
Los contemporáneos de Leeuwenhoeek, como
Hooke construyeron microscopios compuestos, con múltiples lentes, de hecho se
le adjudica al óptico holandés Zacharias Janssen la construcción del primer
microscopio compuesto alrededor de 1600. Sin embargo estos primeros
microscopios compuestos eran de baja calidad y no podían utilizarse para
observar bacterias. Recién en 1830 Joseph Jackson Lister (el padre de Joseph
Lister) construyo un microscopio de una calidad mucho mayor .Varias mejoras del
microscopio de Lister dieron como resultado el desarrollo del microscopio
compuesto moderno, que es el tipo utilizado en la actualidad en los laboratorio
de microbiología. Los estudios microscópicos de muestras de materia viva han
revelado interacciones espectaculares entre los microbios.
El termino microscopia óptica se refiere
al empleo de cualquier clase de microscopios que utilice la luz visible para
observar las muestras.
La microscopia es el método que se
utiliza con mayor frecuencia tanto para la detección directa microorganismos en
las muestras médicas como para la caracterización de los microorganismos que
crecen en los cultivos.
La microscopia se define como el empleo
de un microscopio para aumentar de tamaño (es decir un agrandamiento visual)
objetos demasiados pequeños para ser observados a simple vista con el propósito
de que puedan verse con facilidad sus características. Dado que la mayoría de
los agentes infecciosos no pueden detectarse a simple vista, la microscopia
desempeña un papel importante en el laboratorio. Los microscopios y los
diferentes métodos de observación microscópica son varios pero aquí solo se
describirán los más utilizados en el diagnostico microbiológico. Los tipos de
microorganismos que se van a detectar, identificar y caracterizar determinan
los tipos de microscopia que es más apropiada emplear.
Los cuatro tipos de microscopias más
utilizadas en el diagnostico microbiológica son:
Microscopia de campo claro (conocida
también como microscopia de luz u óptica),
Microscopia de fluorescencia,
Microscopia de campo obscuro y la Microscopia electrónica.
1. Estructura y
manejo del microscopio óptico
Las partes esenciales que componen un
microscopio óptico son:
Parte
mecánica
Pie o soporte:
Sirve como base al microscopio y en él
se encuentra la fuente de iluminación.
Platina:
Superficie sobre la que se colocan las
preparaciones. En el centro se encuentra un orificio
que permite el paso de la luz. Sobre la
platina hay un sistema de pinza o similar, para sujetar
el portaobjetos con la preparación, y
unas escalas que ayudan a conocer qué parte de la
muestra se está observando. La platina
presenta 2 tornillos, generalmente situados en la
parte inferior de la misma, que permiten
desplazar la preparación sobre la platina, en sentido
longitudinal y transversal
respectivamente.
Tubo:
Cilindro hueco que forma el cuerpo del
microscopio. Constituye el soporte de oculares y
objetivos.
Revólver porta
objetivos: estructura giratoria que contiene los objetivos.
Brazo o asa: une el tubo a la
platina. Lugar por el que se debe tomar el microscopio para
trasladarlo de lugar.
Tornillo macrométrico
o de enfoque grosero:
Sirve para obtener un primer enfoque de
la muestra al utilizarse el objetivo de menor
aumento. Desplaza la platina
verticalmente de forma perceptible.
Tornillo micrométrico
o de enfoque fino:
Sirve para un enfoque preciso de la
muestra, una vez que se ha realizado el enfoque con el
macrométrico. También desplaza
verticalmente la platina, pero de forma prácticamente
imperceptible. Es el único tornillo de
enfoque que se utiliza, una vez realizado el primer
enfoque, al ir cambiando a objetivos de
mayor aumento.
Parte
óptica
Oculares:
Son los sistemas de lentes más cercanos
al ojo del observador, situados en la parte superior
del microscopio. Son cilindros huecos
provistos de lentes convergentes cuyo aumento se
reseña en la parte superior de los
mismos (normalmente 10X en los microscopios que se
utilizarán en esta práctica).
Dependiendo de que exista uno o dos oculares, los microscopios
pueden se mono o binoculares.
Objetivos:
Son sistemas de lentes convergentes que
se acoplan en la parte inferior del tubo, mediante
el revólver. En esta estructura se
pueden acoplar varios objetivos (ordenados de forma
creciente según sus aumentos, en el
sentido de las agujas el reloj). Un anillo coloreado es
distintivo de los aumentos de cada
objetivo, que también van reseñados en el lateral del
mismo. Algunos objetivos no enfocan bien
la preparación al aire, y se deben de utilizar con
un aceite de inmersión (normalmente
van marcados con un anillo rojo). Estos objetivos de
inmersión no se
utilizarán normalmente en estas prácticas.
Condensador:
Sistema de lentes convergentes que capta
los rayos de luz y los concentra sobre la
preparación, de manera que proporciona
mayor o menos contraste. Se regula en altura
mediante un tornillo (letra J de la
figura).
Fuente de
iluminación:
En los microscopios a utilizar, el
aparato de iluminación está constituido por una lámpara
halógena de bajo voltaje (12V) situada
en el pie del microscopio. La luz procedente de la
bombilla pasa por un reflector que envía
los rayos luminosos hacia la platina.
Diafragma o iris:
Sobre el reflector de la fuente de
iluminación. Abriéndolo o cerrándolo permite graduar la
intensidad de la luz.
Transformador:
Ya que el voltaje de la bombilla es
menor que el de la red, es necesario para enchufar el
microscopio. Algunos modelos ya lo
llevan incorporado en el pie del microscopio. Además, el transformador dispone
de un potenciómetro para regular la intensidad de la luz.
Montaje y enfoque de
una preparación microscópica
Antes de observar la preparación al
microscopio, esta debe de ser montada sobre vidrio.
Para ello existen dos piezas de vidrio
denominadas portaobjetos (porta), que, como su
nombre indica, es el soporte sobre el
que va la muestra, y cubreobjetos (cubre) que siempre
ha de colocarse sobre la muestra. Una
vez colocada la muestra en el porta, se debe añadir
una gota de agua, o de la solución
acuosa pertinente, antes de colocar el cubre, para evitar
interfaces agua-aire, que provocan zonas
ciegas.
Para enfocar la preparación se ha de
seguir de forma minuciosa el protocolo descrito debajo
de la figura.(DESARROLLO)
Consejos prácticos
1) En los microscopios que requieren
transformador, el enchufe a la red y desenchufe
debe hacerse sobre el transformador, y
nunca debe desenchufarse el microscopio del
transformador.
2) Se debe mantener apagada la luz del
microscopio siempre que no se esté utilizando,
ya que la vida media de la bombilla es
corta.
3) Siempre se debe comenzar el enfoque
con el objetivo de menor aumento.
4) Anotar siempre el
número de aumentos con el que se observa la preparación. Para
calcularlo basta multiplicar el número
de aumentos del objetivo por el de los oculares.
Hacer esquemas y
dibujos de lo observado con cada aumento.
5) Salvo que se indique lo contrario no
utilizar nunca el objetivo de inmersión, ya que se
requiere un aceite especial sin el que,
además de no enfocar bien, existe una gran
probabilidad de dañar la lente al rozar
con el cubreobjetos.
6) Una vez enfocada, procurar recorrer,
con los tornillos de la platina, toda la
preparación. El microscopio, además de
una gran herramienta en biología, es un gran
juguete para disfrutar de él
descubriendo el apasionante mundo de lo pequeño, para
ello, hay que rastrear todo este mundo.
El
Microscopio Óptico:
(A)
Oculares
(B) Revolver
(C) Objetivos
(D) Platina
(E) Tornillos Para
Desplazar La Preparación Sobre
La Platina En Sentido
Longitudinal Y Transversal
(F) Condensador
(G) Tornillo Macro
métrico
(H) Tornillo
Micrométrico
( I ) Diafragma Iris
(J) Tornillo Para
Regular La Altura Del Condensador
(K) Interruptor
(L) Regulador De La
Intensidad De Luz
(M) Pinzas Para
Ajustar La
(N) Preparación Sobre
La Platina
Pie O Soporte
Material:
- Muestra de heces fecales
- Agua estancada
- Microscopio
- Porta objetos cubre objetos
- Franela
- Pipeta Pasteur
- Lugol
Desarrollo:
Enfoque Del
Microscopio
Los pasos a seguir para la perfecta
utilización del microscopio son las siguientes:
a) Enchufar el microscopio al
transformador y éste a la red.
b) Colocar la preparación sobre la
platina de forma que la estructura a observar quede en
el orificio central de la platina.
c) Poner el objetivo de menor aumento
cuyo amplio campo visual facilita el hallazgo de
estructuras importantes.
d) Subir la pletina accionando el
tornillo micrométrico y mirando la preparación desde
fuera hasta alcanzar el tope superior.
En ningún caso tocar la preparación con los
objetivos.
e) Mirando por los oculares, bajar
lentamente la platina con el tornillo macro métrico
hasta conseguir ver el objeto lo más
nítido posible.
f) Ajustar el enfoque con el tornillo
micrométrico hasta verlo claramente.
g) Para observar la preparación a
mayores aumentos cambiar de objetivo con un simple
giro del revólver. Las pequeñas
variaciones que se observan en el enfoque se
producen al cambiar de objetivo y se
corrigen con el micro.
h) Para observar otros campos, desplazar
la preparación moviendo los tornillos de la
platina.
Para cambiar la
preparación:
Bajar la platina.
Colocar el objetivo de menor aumento
Quitar la preparación y colocar la siguiente
Para desconectar el
microscopio, además de los tres pasos anteriores se realiza lo
siguiente:
Apagar y desenchufar el transformador
de la red
Tapar el microscopio con su funda
SEGUNDA
PARTE
ACTIVIDAD
EXPERIMENTAL:-
En el desarrollo de esta actividad se
utilizaran 2 tipos de preparaciones:
a) Preparaciones frescas o húmedas
b) Preparaciones fijas
Las primeras se realizan unos minutos
antes de su observación y se pueden utilizar
una gran diversidad de materiales como.
Tejidos vegetales y animales, eritrocitos,
bacterias etc., pero existe un
inconveniente este tipo de preparaciones no podemos
guardarla por mucho tiempo.
Una preparación fija se puede guardar
por un tiempo indefinido, para prepararla
podemos utilizar el material a observar
(pueden ser esporas, células,
microorganismos, cortes de tejidos
etc.), al cual se le agrega resina sintética, cera o
bálsamo de Canadá y finalmente se le
coloca un cubreobjetos. Al hacer la fijación se
debe evitar que queden burbujas de aire
en la preparación porque distorsiona la
imagen
MATERIAL Y EQUIPO
MUESTRAS
Microscopio compuesto
Cultivos bacterianos y de hongos
Portaobjetos 1
cabello claro y 1 cabello oscuro
Cubreobjetos Agua
estancada
1 frasco gotero 1
hoja vegetal
Papel absorbente
Preparaciones fijas
Pinzas de disección 1
muestra pequeña de tejido muscular de pollo
Agujas de disección 1
insecto pequeño (zancudo, piojo, pulga etc.)
Una caja de petri
desechable Aceite de inmersión
Colorantes(opcional)
Manual de Practicas
Procesar Técnicas
Bacteriológicas Básicas Página 37
Desarrollo
I.-Preparaciones
húmedas o frescas:
Realiza un montaje húmedo con muestras
de cultivos bacterianos y de hongos por
separado de la siguiente manera:
De las cajas que contiene los
cultivos, tomar una pequeña muestra y colocarla sobre
un portaobjetos, agregar una gota de
colorante y diluir la muestra de cultivo con ayuda
de una aguja de disección, colocar un
cubreobjetos y observa al microscopio.
Enfoca el microscopio como se menciono
anteriormente y realiza las observaciones
correspondientes.
Elabora un esquema de cada una de las
observaciones, anota en la parte inferior en
número de aumentos con los que
observaste (10X y 40X) que corresponden al
enfoque realizado.
Realiza las preparaciones en fresco
del insecto, tejido vegetal, tejido animal, cabellos
y agua estancada siguiendo el
procedimiento realizado anteriormente.
Anota tus observaciones y dibujos
correspondientes.
Preparaciones
fijas
Realiza las observaciones de las
preparaciones fijas que te proporciones el profesor,
con el objetivo 10X, 40X y 100X (en este
objetivo agregaremos una gota de aceite de
inmersión a la preparación para
observarla).
Anota las observaciones y dibuja.
RUTA
DE TRABAJO
RESULTADOS:
Dibujos de cada una
de las preparaciones, en fresco y fijas, con los aumentos
utilizados.
DISCUSION:
CONCLUSION:
BIBLIOGRAFIA
Practica 6
Practica Nº 6
ELABORACIÓN
DE MEDIOS DE CULTIVO PARA SEMBRADO MICROBIOLÓGICO
Objetivo
General.-
Aprender
a elaborar correctamente medios de cultivo dependiendo del medio que se vaya
a
utilizar.
Objetivos
Particulares.-
1.-
Establecer las medidas de seguridad para elaborar un medio de cultivo
2.-
Conocer las cantidades de medio que se utiliza según lo que se vaya a utilizar
3.-
Conocer que medio se utiliza para reconocer cada tipo de bacteria
INTRODUCCION
Un medio
de cultivo es un sustrato o solución de nutrientes en los que crecen y se
multiplican
los microorganismos.
Los
medios de cultivo son necesarios para cultivar a los microorganismos en el
laboratorio
y realizar procedimientos especializados como identificación de distintos
microorganismos
como lo son las bacterias, análisis de agua y aislamiento de
microorganismos
particulares.
Existen
diferentes medios para lograr estos análisis y otros.
Composición
de un medio de cultivo:
Agar.
El agar
es un agente solidificado porque una vez que se funde con agua.
Polímero
sulfatado compuesto principalmente de D galactosa, 3-6 anhidrido L,
galactosa
y acido D. Que es un polisacárido y que se obtiene de ciertas algas marinas.
El agar
es un buen agente solidificarte porque no se funde con agua hirviendo, puede
enfriarse
hasta una temperatura de 40º C sin endurecerse.
Peptonas.
Son
mezclas complejas de compuestos orgánicos nitrogenados y sales minerales que
se
obtienen por digestión enzimático o químico de proteína animales o vegetales.
Las
peptonas
son muy ricas en péptido y aminoácidos pero pueden ser diferentes en
determinadas
vitaminas y sales.
Extractos.
Para su
preparación ciertos órganos o tejidos son extraídos con agua y alcohol y
posteriormente
concentrados hasta la forma final de pasto o polvo.
Fluidos
corporales.
Sangre
completa, sangre desfibrinada, plasma o suero sanguíneo son frecuentemente
añadidos
a los medios empleados para el cultivo de algunos patógenos. La sangre no
puede ser
esterilizada y debe por tanto, ser obtenida en condiciones asépticas
directamente
de un animal sano.
Sistemas
amortiguadores.
Algunos
componentes son incorporados a los medios de cultivo para mantener y sales
como
fosfato disódico o dipotásico o sustancias como las peptonas previenen una
desviación
del pH.
Indicadores
de pH.
Los
indicadores de pH son incorporados en algunos medios de cultivo y dan evidencia
visual de
los cambios de pH que ocurren.
Agentes
reductores.
Cisterinas,
tioglicolato y otros que se añaden a los medios de cultivo para crear
condiciones
que permitan el desarrollo de los gérmenes microaerófilos y anaerobios.
Agentes
selectivos.
La
adición de determinadas sustancias al medio de cultivo puede convertirlo en
selectivo,
a la concentración adecuada actúan como medios selectivos frente a
determinados
microorganismos.
Material:
1
paquete de cajas de Petri sin división
1
paquete de cajas de Petri con 2 divisiones
1
paquete de cajas de Petri con 3 divisiones
Medios
de cultivo
Mechero
Autoclave
Balanza
granataria
1
franela
Encendedor o cerrillos
Agar
Algodón
Papel
destraza
Bata de
laboratorio
Gasas
Tijeras
PROCEDIMIENTO:
1. Preparar
el número de cajas que se le indique para cada medio de cultivo.
2.
Consultar el manual de medios de cultivo o el instructivo que viene en el
reverso del
frasco de
cada medio de cultivo.
3. Los
medios de cultivo a preparar son los siguientes:
Agar sal
y manitol o agar 110
Eosina y
azul de metileno.
Agar soya
tripticaseina.
Agar de
Mar Conkey.
Agar
Mueller Hinton.
Agar
salmonella sigella
Agar
verde brillante
Agar
biggy
RUTA
DE TRABAJO:
RESULTADOS:
Realizar
los dibujos, procedimiento, composición y cálculos realizados de cada uno de
los
medios
elaborados:
Agar sal
y manitol o agar 110
Eosina y
azul de metileno.
Agar soya
tripticaseina.
Agar de
Mar Conkey.
Agar
Mueller Hinton.
Agar
salmonella sigella
Agar
verde brillante
Agar
biggy
DISCUSIÓN.
CONCLUSIÓN.
BIBLIOGRAFÍAS.
CUESTIONARIO
Practica 7
Prática
No. 7
TÉCNICAS
DE SEMBRADO MICROBIOLÓGICO
Objetivo
general
Que el
alumno aprenda a realizar correctamente las técnicas de sembrado que se
utilizan
con más frecuencia en microbiología.
Objetivos
particulares.
1.-
Realizar correctamente las estrías masivas en un medio de cultivo
2.-
Conocer qué medidas se toman para realizar un buen estriado
3.-
Conocer el tipo de estriado según la caja de petri que se utilice
Introducción.
Un método
fundamental para estudiar las bacterias es cultivarlas en un medio líquido o en
la
superficie
de un medio sólido de agar.
Los
cultivos de bacterias provenientes de infecciones en diversos sitios corporales
se llevan
a cabo
mediante la siembra de muestras procesadas directamente en los medios
artificiales.los
medios de cultivo y las condiciones de incubación se seleccionan de acuerdo
con su
capacidad para favorecer el crecimiento de las bacterias con mas probabilidades
de
estar
implicadas en el proceso infeccioso.
Los
medios de cultivo contienen distintos nutrientes que van, desde azucares
simples hasta
sustancias
complejas como la sangre o el extracto de caldo de carne. Para aislar o
purificar
una
especie bacteriana a partir una muestra formada por muchos tipos de bacterias,
se
siembra
en un medio de cultivo sólido, donde las células que se multiplican no cambian
de
localización
tras muchos ciclos reproductivos, cada bacteria individual genera por escisión
binaria
una colonia macroscópica compuesta por decenas de millones de células similares
a
la
original. Si esta colonia individual se siembra a su vez en un nuevo medio
crecerá como
cultivo
puro de un solo tipo de bacteria.
El
estudio organizado de cualquier microorganismo requiere que se examine una
especie a
la vez,
el método analítico no se puede aplicar cuando se trata de una mezcla de varias
especies
a la vez. Uno de los problemas más frecuentes en microbiología es el
aislamiento
de un
cultivo puro de una especie bacteriana dada.
Sin duda
la técnica más comúnmente usada es la de estría cruzada, empleada para lograr
un
cultivo
puro, método llamado también sembrado en estría. El material que se recomienda
para la
siembra es un alambre de nicromo o platino en forma recta en forma de asa, un
extremo
del alambre se inserta a un mango cilíndrico para facilitar su manejo. Esta
técnica
incluye
la diseminación de una azada de material con los microorganismos sobre la
superficie
de un medio de agar que se ha solidificado.
El propósito
de esta técnica es diluir el inoculo sobre la superficie del agar como para
poder
obtener
colonias bacterianas bien aisladas a partir de Unidades Formadoras de Colonias
(UFC).
Las colonias aisladas se pueden luego subcultivar individualmente transfiriéndolas
a
otros
medios a fin de obtener cultivos puros que pueden ser estudiados.
Muchas
especies bacterianas son tan parecidas morfológicamente que es imposible
diferenciarlas
solo con el uso de microscopio; en este caso, para identificar cada tipo de
bacteria,
se estudian sus características bioquímicas sembrándolas en medios de cultivo
especiales.
En
algunos medios se añaden indicadores de pH que cambian de color cuando uno de
los
nutrientes
del medio es fermentado y se generan catabólicos ácidos.
Si las bacterias
son capaces de producir fermentación, generan gases que pueden ser
apreciados
cuando el cultivo se realiza en un tubo cerrado.
Material.
Franela
Masking
tape
Marcador indeleble
Encendedor
Asa
bacteriológica de 1 en 100
Hisopos
estériles
Abate
lenguas
Guantes
Gasas
Cepas
bacterianas
Procedimiento
Aislamiento
de un cultivo bacteriano en placa por el Método de estría cruzada
1)
Desinfectar perfectamente el área de trabajo con el desinfectante que se
utiliza
rutinariamente
y en seguida prenda el mechero y espere ente 3-5 minutos para
trabajar
dentro del área de seguridad que proporciona la flama del mechero (no mayor
de 30 cm
de diámetro).
2)
Realizar el trabajo sentado, cerca del mechero, esterilizar el asa por método
de flameo
correspondiente
hasta llevar al rojo vivo.
3)
Enfriar el asa contando de 20 o 30 segundos o bien en uno de los extremos de la
placa de
agar que podrá servir como punto inicial cuando se desarrolle la técnica de
estría
cruzada en cada uno de los extremos de la placa.
4)
Después tomar una azada de la muestra (cultivo bacteriano en caja de Petri, en
tubo
de
ensaye, cultivo bacteriano mixto en caldo o muestra biológica).
5) A
continuación tomar con la mano izquierda la caja de Petri si es diestro, o con
la
derecha
si es surdo, de manera que la base de la caja repose sobre la palma de la
mano y la
tapa pueda manipularse hacia arriba y hacia abajo con el dedo pulgar y el
dedo
medio.
6)
Levantar la cubierta de la caja de Petri y colocar en la superficie del agar el
inoculo de
lado a
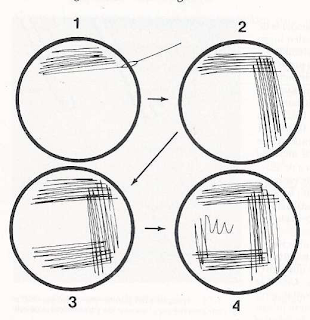
lado, trazando 5 líneas paralelas continuas como se muestra en la figura 1.
7) Bajar
la cubierta de la caja y flamear el asa de inocular.
8) Hacer
girar la caja de Petri un cuarto de vuelta, levantar la cubierta y enfriar el
asa de
inocular
nuevamente contando de 20 a 30 segundos o bien tocando el agar del medio
de
cultivo lejos del conjunto de estrías recién hechas.
9)
Realizar 5 líneas paralelas continuas de lado a lado tocando la superficie del
conjunto
original
de estrías con el asa de inocular, formado de esta manera el segundo
conjunto
de estrías (ver figura 2).
10)Bajar
la tapa de la caja y repetir los pasos 6, 7,8 y 9), formando el tercer (ver
figura 3).
11)Nuevamente
bajar la tapar y repetir los pasos del 6 al 10, solamente que para formar
el cuarto
grupos de estrías estas serán más amplias y abiertas sin tocar ningún grupo
de
estrías que ya esta hechas, ver figura 4.
12)Finalmente
flamear el asa de inocular.
13)Colocar
las cajas de Petri boca abajo y etiquételas con su nombre, grupo y equipo.
14)Incubar
las cajas de Petri a 37 0C durante 24 - 48 horas en la estufa bacteriológica.
15)Tome
fotografías frente al mechero para ver el estriado realizado y anexar a sus resultados.
Técnica
de estría masiva
Con el
asa previamente esterilizada, tomar una azada de una muestra y trazar una cruz
en la
caja con
el medio de cultivo a utilizar, posteriormente esterilizar el asa y estriar en
toda la
caja
procurando que las estrías sean lo más cercanas una de otra en toda la
caja.(este
método se
puede realizar con asa o con hisopo), como se muestra en la siguiente figura:
Ruta
de trabajo:
Representar
con dibujos o tomar fotografías del procedimiento realizado. Anexarlo a tus
resultados
RESULTADOS.
DISCUSIÓN.
CONCLUSIÓN.
BIBLIOGRAFÍA.
Practica 8
Practica No. 8
SELECCIÓN
DE COLONIAS Y MORFOLOGÍA COLONIAL DE MICROORGANISMOS
Objetivo
general
Que el
alumno aprenda a describir la morfología colonial bacteriana.
Objetivos
específicos.
1.-
Identificar cada tipo de elevación de la colonia que se presente
2.-
Identificar la morfología sin que el medio de cultivo se contamine
3.-
Conocer la morfología de bacterias mas comunes
Introducción.
Una de
las características principales de las bacterias es su apariencia
(características de su
desarrollo)
seguida del crecimiento en los diferentes medios de cultivo.
Los
microorganismos que crecen sobre la superficie solida, tienden a formar
agrupaciones
que se
denominan colonias, las colonias suelen ser de características constantes para
el
medio de
cultivo usado, la temperatura de incubación y el microorganismo del que se
trate,
por lo
que su estudio es de gran utilidad tanto en la clasificación como en la
identificación.
Una
colonia microbiana está constituida por individuos de la misma especie
provenientes de
una
célula y de un grupo de ellas, llamadas Unidades Formadoras de Colonias (UFC).
Las
colonias aisladas se pueden subcultivar individualmente transfiriéndolas a
otros medios
de
cultivo a fin de obtener cultivos puros y pueden ser estudiadas en medios
diferenciales. Y
la
evaluación de las características macroscópicas de las colonias se lleva a cabo
usualmente
mediante el examen visual del desarrollo en la superficie de las placas de
agar.
La
inspección de los cultivos se lleva a cabo sosteniendo la placa con una mano y
observando
la superficie del agar para comprobar la presencia del desarrollo bacteriano.
Las
placas de
cultivo comunes tienen 100 mm de diámetro y son adecuadas y pueden
sostenerse
en una mano. Se debe estudiar con cuidado a cada placa debido a que las
bacterias
aisladas inicialmente a partir de la muestra, constituyen a menudo cultivos
mixtos y
pueden
haber una gran variedad de tipos de colonias.
La
evaluación macroscópica de las colonias se lleva acabo usualmente mediante el
examen
visual
del desarrollo en la superficie de las placas de agar.
Los tubos
que contienen los medios primarios no se utilizan comúnmente para evaluar la
morfología
colonial pero una excepción a esto es el tubo rotatorio con estría utilizado
por el
laboratorio,
este sistema sirve para el estudio de anaerobios ya que la evaluación de la
morfología
de las colonias se puede efectuar directamente a través del vidrio de los tubos
sin
exponer
los organismos al aire durante el examen.
La
interpretación de cultivos primarios es una habilidad que se debe adquirir
trabajando con
un
microbiólogo, bien capacitado y generalmente se logra dominar solo luego de
muchos
años de
experiencia, la inspección de los cultivos se lleva acabo sosteniendo la placa
con
una mano
y observando la superficie de agar puro comprobar el desarrollo bacteriano.
Las
características consideradas para la descripción de la morfología colonial de
las
bacterias
se describen a continuación:
Términos
utilizados en la caracterización colonial
Tamaño:
Diámetro
en mm.
Forma:
Puntiforme,
circular, filamentosa, irregular, rizoide, fusiforme.
Elevación: Plana, elevada,
convexa, pulvinada, embonada, umbilicada.
Borde
o Margen: Entero, ondulado, lobulado, erosionado o lacerado, filamentoso,
rizado.
Color:
Blanco,
amarillo, negro, marrón, anaranjado, beige, otros.
Superficie:
Lisa,
rugosa o granular, brillante, opaca.
Densidad:
Opaca,
translucida, transparente, etc.
Consistencia:
Suave:
Butirosa (mantequillosa, grasosa), mucoide o membranosa,
Dura:
Quebradiza o friable( que se rompe con facilidad), seca
NOTA: Esta
característica se determina tocando la colonia con el asa de siembra o aguja de
inocular
por lo
tanto debe ser la última en describirse.
Luz
reflejada: Brillante o mate (que no brilla).
Luz
transmitida: Translucida (Transparente) u opaca.
Material.
Bata
Guantes
Cubre
bocas
Asa
bacteriológica
Mechero
Cinta
testigo
Procedimiento.
1.-
Preparar los siguientes medios de cultivo (EMB, Sal y Manitol) de acuerdo al
procedimiento
visto en la práctica No 4.
2.-Dejar
solidificar los medios y se envuelve en papel estraza y dejar reposar unos
días,
antes
someterlos a prueba de esterilidad..
3.-Sembrar
en la caja que contengan el medio de cultivo EMB se hace por estría
cruzada.
4.-Sembrar
en la caja con medio de Sal y Manitol, por estría cruzada.
5.-Se
incuban de 24 – 48 horas.
6.-Identificar
las colonias y describir de acuerdo a las siguientes características:
Tamaño,
forma, color, superficie, aspecto, consistencia, elevación, margen, luz
traslucida
y luz
reflejada. Anotar sus observaciones.
SEGUNDA
PARTE:
Trabajo
a desarrollar:
Examinar
los diferentes cultivos proporcionados, utilizando los diagramas que acompañan
a
esta
práctica, mencionando las características correspondientes de cada cultivo
bacteriano.
Morfología
colonial:
Describir
las colonias aisladas en cada medio de cultivo, indicando las características
de la
morfología colonial antes descritas.
En su
cuaderno de reportes de laboratorio, en la sección de resultados hacer y llenar
la tabla
que muestra a continuación:
|
CARACTERISTICAS
|
COLONIA
1
|
COLONIA
2
|
COLONIA
3
|
|
MICROORGANISMO
|
|
|
|
|
MEDIO
DE CULTIVO
|
|
|
|
|
TAMAÑO
(mm)
|
|
|
|
|
FORMA
|
|
|
|
|
ELEVACION
|
|
|
|
|
BORDE O
MARGEN
|
|
|
|
|
DENSIDAD
|
|
|
|
|
COLOR
|
|
|
|
|
SUPERFICIE
|
|
|
|
|
ASPECTO
|
|
|
|
|
LUZ
REFLEJADA
|
|
|
|
|
LUZ
TRANSMITIDA
|
|
|
|
|
CONSISTENCIA
|
|
|
|
Si
identifican otras características diferentes a las que se mencionaron antes,
anotarlas
en la tabla.
INDICACIONES:
La
inspección de cultivos se llevan a cabo sosteniendo la placa con una mano y
observando
la superficie del agar para comprobar la presencia del desarrollo
bacteriano.
Se deben estudiar con cuidado cada una de las placas, debido a que las
bacterias aisladas
inicialmente a partir de muestras, constituyen a menudo cultivos
mixtos y puede haber
una variedad de diferentes tipos de colonias.
Las colonias
puntiformes pueden pasar inadvertidas entre las de mayor tamaño. Se
debe inclinar la
placa en distintas direcciones con iluminación brillante directa. Se
pueden ayudar con una
lupa de mano de gran aumento, para detectar colonias
pequeñas, el asa de
siembra y la aguja de inoculación nos ayuda a conocer la
consistencia de las
colonias. Siempre reporte el medio de cultivo y el tiempo de
incubación.
Ruta de trabajo.
Resultados.-
Dibujar la morfologia
colonial del crecimiento bacteriano en los siguientes
medios:
1.-EMB
2.-Sal y Manitol
Discusión.
Conclusión.
Suscribirse a:
Comentarios (Atom)